栏目分类
你的位置:赣州眯陕殖企业管理有限公司 > SCSI连接器 > 《当然》: 再造大脑干细胞! 科学家找到将星形胶质细胞重编程为神经干细胞的门径
《当然》: 再造大脑干细胞! 科学家找到将星形胶质细胞重编程为神经干细胞的门径
发布日期:2024-09-13 06:04 点击次数:159

*仅供医学专科东谈主士阅读参考


在咱们的大脑中,不同类型的脑细胞协同使命,脑细胞主要可分为两大类:神经元和神经胶质细胞,最常见的神经胶质细胞当属星形胶质细胞,它们为神经元提供能量,亦然血脑障蔽的构成部分,还具有和洽突触和因循免疫细胞的智商。
有一小部分星形胶质细胞聚居在成年大脑的异常区域,省略产生神经元和神经胶质细胞,它们即是神经干细胞,神经干细胞和庸碌星形胶质细胞的基因抒发确凿莫得各异,但它们的功能却如斯不同,这种各异是奈何产生的?此前,科学家们对此澈底不明晰。
但是最近,德国癌症盘问中心(DKFZ)和德国海德堡大学的盘问团队揭示了这个问题的谜底,将最新盘问后果发表在顶级期刊《当然》上[1]。
他们发现,转折在于表不雅遗传学的各异,神经干细胞比较星形胶质细胞具有异常的DNA甲基化形式,干细胞功能是由星形胶质细胞基因的甲基化和其后抒发的干细胞基因的去甲基化介导的。他们还发现,大脑缺血会触发星形胶质细胞向神经干细胞的重编程,由DNA甲基出动酶3α(DNMT3A)介导。这为成体神经元再生盘问提供了新的但愿。

在很长的一段时候里,学界王人以为哺乳动物成年后,大脑就不会产生新的神经元了,但是其后的盘问揭示,新神经元照旧不错产生的,仅仅存在于特定的脑区中,包括齿状回和脑室-脑室下区(vSVZ)。
小鼠vSVZ中的神经干细胞在激活后成为转运扩增祖细胞,资历多轮分裂并产生神经母细胞,随后移动到嗅球,分化为神经元,整合入神经回路,也会有一小部分分化为神经胶质细胞。神经干细胞不错处于静息或激活情景,静息神经干细胞中与星形胶质细胞表型干系的基因,包括参与脂质代谢和糖酵解的基因的抒发在过渡到激活情景技能冉冉下跌。
因此,盘问东谈主员使用单细胞核小体、甲基化组和转录组测序(scNMT-seq)同期对成年小鼠的神经干细胞的转录组、染色质可及性和DNA甲基化进行了表征。
他们发现,静息与激活的神经干细胞的甲基化特征明显分离,静息情景与其他不同脑区的星形胶质细胞相当相同,但由于抒发干细胞象征物TLX和TROY,不错与其他星形胶质细胞划分开来,盘问东谈主员将它们称为vSVZ星形胶质细胞。
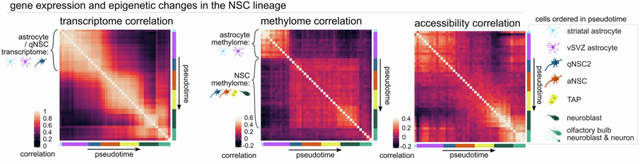
静息与激活的神经干细胞的转录组、DNA甲基化和染色质可及性
通过拟合不同技能点的甲基化水平,盘问东谈主员揭示了从vSVZ星形胶质细胞到激活的神经干细胞这一溜变中的甲基化和去甲基化变化,篡改时,星形胶质细胞干系象征物的甲基化急剧增多。在转运扩增祖细胞阶段晚期,盘问东谈主员不雅察到一批主要在神经母细胞中抒发的基因的去甲基化,标明这一阶段去甲基化为神经母细胞基因的后期抒发提供了铺垫。
vSVZ星形胶质细胞和激活的神经干细胞之间的各异化甲基化区域中,vSVZ星形胶质细胞的低甲基化出当今参与氨基酸(Slc1a2和Glul)、离子(Slc41a2)和胆固醇(Lcat)等物资转运和代谢的基因隔壁,激活的神经干细胞的低甲基化出当今细胞分化(Ascl1和Dlx1)和DNA聚会(Nkx2-2和Pax8)和洽因子隔壁,像Slc1a2等一些基因的甲基化水平在激活的神经干细胞中则显赫升高。
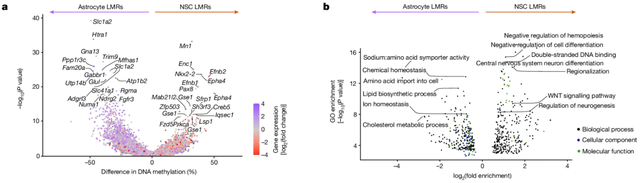
vSVZ星形胶质细胞和激活的神经干细胞之间的各异化甲基化基因和路线
先前的盘问发现,脑缺血性挫伤不错增多神经母细胞的产生,以及vSVZ中的星形胶质细胞在被缺血性挫伤激活后会以侵犯素依赖性的样貌离开静息情景,这种变化是否与甲基化重塑关联?
盘问东谈主员汲取了2月龄的小鼠,让它们资历了22分钟的片霎性举座脑缺血,导致了纹状体中的中等多棘神经元和白质的挫伤,但莫得对vSVZ形成影响。
比较未科罚的小鼠,缺血2天后,小鼠的vSVZ和纹状体中,神经球形成王人有所增多,这是由于大浩繁vSVZ星形胶质细胞转机为了激活的神经干细胞,它们发达出与前述激活的神经干细胞相一致的甲基化特征,这标明脑缺血小鼠的神经发生随神经干细胞的甲基化变化增多。21天后,这种变化消散。
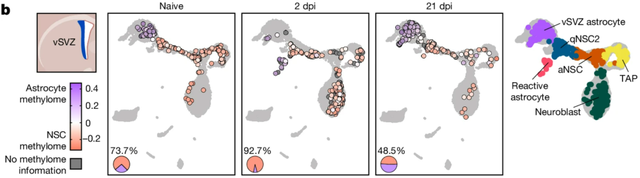
vSVZ中,缺血后2天(2dpi)小鼠激活的神经干细胞占比显赫增多,21天后变化消散
第21天时检测的各异化甲基化区域与编码DNA甲基出动酶3α(DNMT3A)的Dnmt3a基因重复,DNMT3A崇敬DNA的重新甲基化,盘问东谈主员发现,在Dnmt3a缺失的小鼠中,脑缺血确凿无法增多神经发生,标明DNMT3A是这仍是过的伏击介导身分。
综上,这项盘问揭示了成年的大脑中,具有干细胞特征的星形胶质细胞与激活的神经干细胞尽管转录组邻近,但甲基化组各异明显,通过脑缺血等样貌调控甲基化的变化,不错将它们重编程为激活的神经干细胞,促进神经发生,为通过再生医学诊疗神经疾病提供了新的可能。
参考文件:
[1] Kremer L P M, Cerrizuela S, El-Sammak H, et al. DNA methylation controls stemness of astrocytes in health and ischaemia[J]. Nature, 2024: 1-9.

